
वीडियो: सल्फर ट्राइऑक्साइड का आवेश क्या है?
2024 लेखक: Miles Stephen | [email protected]. अंतिम बार संशोधित: 2023-12-15 23:36
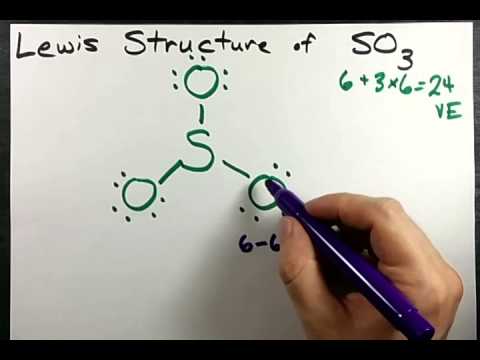
इलेक्ट्रॉन-गणना औपचारिकता के संदर्भ में, गंधक परमाणु की ऑक्सीकरण अवस्था +6 और एक औपचारिक है चार्ज 0 का। लुईस संरचना में एक S=O होता है। डी-ऑर्बिटल्स का उपयोग किए बिना डबल बॉन्ड और दो एस-ओ डाइवेटिव बॉन्ड। गैसीय का विद्युत द्विध्रुवीय क्षण सल्फर ट्रायऑक्साइड इस्ज़ीरो
इसके बाद, कोई यह भी पूछ सकता है कि so3 का शुल्क क्या है?
ऑक्सीकरण बताता है SO3 (जी) हैं: सल्फर (+6) और ऑक्सीजन (-2), क्योंकि SO3 (जी) नहीं है चार्ज हालांकि में ( SO3 )2 - (aq) ऑक्सीकरण राज्य हैं: सल्फर (+4) और ऑक्सीजन (-2)। दोनों को भ्रमित न करें, हो सकता है कि वे दोनों बिना लिखे लिखे हों चार्ज , लेकिन अगर SO3 है (aq) इसमें a. होगा चार्ज का -2।
इसके अलावा, सल्फर ट्रायऑक्साइड किसके लिए प्रयोग किया जाता है? यह कुछ धातु आक्साइड के साथ हिंसक रूप से भी प्रतिक्रिया करता है। सल्फर ट्रायऑक्साइड सल्फ्यूरिक ऑक्साइड और सल्फ्यूरिकैनहाइड्राइड भी कहा जाता है। यह है इसके समान इस्तेमाल किया सल्फ्यूरिक एसिड, अन्य रसायनों और विस्फोटकों के उत्पादन में एक मध्यवर्ती।
यह भी जानना है कि क्या so3 जलीय है?
सल्फर ट्राइऑक्साइड ( SO3 ) आम तौर पर एक रंगहीन तरल है। यह बर्फ के रूप में या फाइबर जैसे क्रिस्टल या आग के रूप में भी मौजूद हो सकता है। कब SO3 हवा के संपर्क में है, यह तेजी से पानी लेता है और सफेद धुएं को छोड़ देता है। यह जल के साथ अभिक्रिया कर सल्फ्यूरिक अम्ल बनाता है।
क्या SO3 में द्विध्रुवीय क्षण होता है?
SO3 त्रिकोणीय तलीय है ताकि व्यक्ति द्विध्रुव एसओ बांड पर रद्द करें और अणु है नहीं द्विध्रुव आघूर्ण.
सिफारिश की:
क्या सल्फर में 4 बंधन हो सकते हैं?

इस संरचना में सल्फर के चारों ओर चार इलेक्ट्रॉन होते हैं (इसके चार बंधों में से प्रत्येक में से एक) जो सामान्य रूप से होने वाले वैलेंस इलेक्ट्रॉनों की संख्या से दो इलेक्ट्रॉन कम होते हैं, और इस तरह यह +2 का औपचारिक प्रभार वहन करता है
आयनिक आवेश क्या होते हैं?

आयनिक आवेश एक परमाणु या परमाणुओं के समूह से एक या अधिक इलेक्ट्रॉनों के लाभ (ऋणात्मक आवेश) या हानि (धनात्मक आवेश) द्वारा निर्मित आयन का विद्युत आवेश
क्या विद्युत आवेश केवल विद्युत का गुण है या आवेश सभी परमाणुओं का गुण है?

एक धनात्मक आवेश ऋणात्मक आवेश को आकर्षित करता है और अन्य धनात्मक आवेशों को पीछे हटाता है। क्या विद्युत आवेश केवल विद्युत का गुण है या आवेश सभी परमाणुओं का गुण है? विद्युत आवेश सभी परमाणुओं का एक गुण है
विद्युत आवेश के 3 नियम क्या हैं?

आपके द्वारा किए गए प्रयोगों के समान प्रकार के आधार पर, वैज्ञानिक विद्युत आवेशों के तीन नियम स्थापित करने में सक्षम थे: विपरीत आवेश एक दूसरे को आकर्षित करते हैं। जैसे आवेश एक दूसरे को प्रतिकर्षित करते हैं। आवेशित वस्तुएँ उदासीन वस्तुओं को आकर्षित करती हैं
एक परमाणु के 3 कण और उनके संबंधित आवेश क्या हैं?

प्रोटॉन, न्यूट्रॉन और इलेक्ट्रॉन एक परमाणु में पाए जाने वाले तीन मुख्य उप-परमाणु कण हैं। प्रोटॉन का धनात्मक (+) आवेश होता है। इसे याद रखने का एक आसान तरीका यह याद रखना है कि प्रोटॉन और सकारात्मक दोनों 'P' अक्षर से शुरू होते हैं। न्यूट्रॉन का कोई विद्युत आवेश नहीं होता है
