विषयसूची:

वीडियो: एक सहसंयोजक बंधन एक आयनिक बंधन प्रश्नोत्तरी से कैसे भिन्न होता है?

2024 लेखक: Miles Stephen | [email protected]. अंतिम बार संशोधित: 2023-12-15 23:36
NS अंतर और के बीच ईओण का और एक सहसंयोजक बंधन ऐसा है कि एक सहसंयोजक बंधन तब बनता है जब दो परमाणु इलेक्ट्रॉन साझा करते हैं। आयोनिक बांड वे बल हैं जो विपरीत आवेशों के बीच आकर्षण के इलेक्ट्रोस्टैटिक बलों को एक साथ रखते हैं आयनों . आयोनिक बांड एक इलेक्ट्रोनगेटिविटी है अंतर 2 से बड़ा या उसके बराबर।
बस इतना ही, एक सहसंयोजक बंधन एक आयनिक बंधन से कैसे भिन्न होता है?
एक आयोनिक बंध धातु और अधातु के बीच बनता है। सहसंयोजक संबंध रसायन का एक रूप है संबंध दो गैर-धातु परमाणुओं के बीच जो परमाणुओं और अन्य के बीच इलेक्ट्रॉनों के जोड़े के बंटवारे की विशेषता है सहसंयोजक बांड.
दूसरे, आयनिक बंधन और सहसंयोजक बंधन क्या है? रासायनिक संबंध रसायन के दो चरम मामले बांड हैं: सहसंयोजक बंधन : गहरा संबंध जिसमें दो परमाणुओं द्वारा एक या एक से अधिक इलेक्ट्रॉन युग्म साझा किए जाते हैं। आयोनिक बंध : गहरा संबंध जिसमें एक परमाणु से एक या एक से अधिक इलेक्ट्रॉन निकाल कर दूसरे परमाणु से जुड़ जाते हैं, जिसके परिणामस्वरूप धनात्मक और ऋणात्मक होता है आयनों जो एक दूसरे को आकर्षित करते हैं।
दूसरे, एक सहसंयोजक बंधन एक आयनिक बंधन प्रश्नोत्तरी क्या है?
आयोनिक बांड . प्रपत्र आयनों , बाहरी कोश के इलेक्ट्रॉनों को प्राप्त करें या खोएं, बाहरी इलेक्ट्रॉन कोश को भरें। सहसंयोजक बांड . अणु बनाते हैं, बाहरी शेल इलेक्ट्रॉनों को साझा करते हैं, बाहरी इलेक्ट्रॉन शेल को भरते हैं।
आयनिक बंधों के कुछ उदाहरण क्या हैं?
आयनिक बंधन उदाहरणों में शामिल हैं:
- LiF - लिथियम फ्लोराइड।
- LiCl - लिथियम क्लोराइड।
- LiBr - लिथियम ब्रोमाइड।
- LiI - लिथियम आयोडाइड।
- NaF - सोडियम फ्लोराइड।
- NaCl - सोडियम क्लोराइड।
- NaBr - सोडियम ब्रोमाइड।
- NaI - सोडियम आयोडाइड।
सिफारिश की:
क्या NaCl में एक गैर-ध्रुवीय सहसंयोजक बंधन होता है?

हाँ, NaCl एक आयनिक बंध है जो इसे ध्रुवीय बनाता है। इलेक्ट्रोनगेटिविटी में अंतर वह है जो एक बंधन को ध्रुवीय या गैर-ध्रुवीय बनाता है। यदि एक बंधन में दो परमाणुओं में समान विद्युतीयता होती है, (उदाहरण के लिए, जिसमें दो समान परमाणु होते हैं) तो बंधन गैर-ध्रुवीय होता है क्योंकि दोनों परमाणुओं में इलेक्ट्रॉनों के लिए समान आकर्षण होता है
क्या हाइड्रोजन बंधन सहसंयोजक बंधन के समान है?
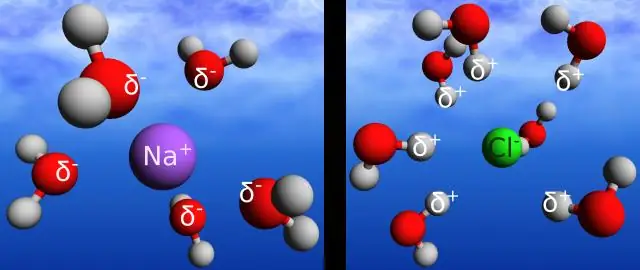
हाइड्रोजन बांड एक हाइड्रोजन परमाणु पर सकारात्मक चार्ज और पड़ोसी अणु के ऑक्सीजन परमाणु पर नकारात्मक चार्ज के बीच इलेक्ट्रोस्टैटिक इंटरैक्शन को दिया गया नाम है। सहसंयोजक बंधन एक ही अणु में दो परमाणुओं के बीच इलेक्ट्रोस्टैटिक संपर्क है
आप प्रयोगात्मक रूप से कैसे निर्धारित कर सकते हैं कि कोई यौगिक आयनिक है या सहसंयोजक?

यह निर्धारित करने के कुछ अलग तरीके हैं कि कोई बंधन आयनिक है या सहसंयोजक। परिभाषा के अनुसार, एक आयनिक बंधन एक धातु और एक अधातु के बीच होता है, और एक सहसंयोजक बंधन 2 अधातुओं के बीच होता है। तो आप आमतौर पर केवल आवर्त सारणी को देखते हैं और निर्धारित करते हैं कि आपका यौगिक धातु/अधातु से बना है या केवल 2 अधातु है
आप भिन्न को पूर्ण संख्या और इकाई भिन्न के गुणनफल के रूप में कैसे लिखते हैं?

एक इकाई भिन्न और एक पूर्ण संख्या का गुणनफल ज्ञात करने के नियम हम पहले पूर्ण संख्या को भिन्न के रूप में लिखते हैं, अर्थात इसे एक से विभाजित करके लिखते हैं; उदाहरण के लिए: 7 को 71 के रूप में लिखा जाता है। फिर हम अंशों को गुणा करते हैं। हम हरों को गुणा करते हैं। यदि किसी सरलीकरण की आवश्यकता है, तो इसे किया जाता है और फिर हम अंतिम भिन्न लिखते हैं
रासायनिक बंधन प्रश्नोत्तरी कैसे होते हैं?

एक रासायनिक बंधन तब होता है जब दो अलग-अलग परमाणुओं में वैलेंस इलेक्ट्रॉनों और नाभिक के बीच परस्पर विद्युत आकर्षण होता है। प्रकृति में अधिकांश परमाणु किस रूप में पाए जाते हैं? प्रकृति में अधिकांश परमाणु रासायनिक बंधों द्वारा आयोजित यौगिकों में पाए जाते हैं
