
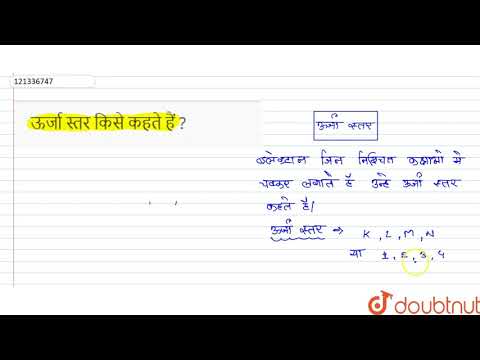
वीडियो: निम्नलिखित प्रमुख ऊर्जा स्तरों में कितने उपस्तर हैं?
2024 लेखक: Miles Stephen | [email protected]. अंतिम बार संशोधित: 2023-12-15 23:36
स्तर एक में एक सबलेवल होता है - एक एस। स्तर 2 है 2 उपस्तर - एस और पी। लेवल 3 में 3 सबलेवल हैं - s, p, और d। लेवल 4 में 4 सबलेवल हैं - s, p, d, और f।
उसके, इन प्रमुख ऊर्जा स्तरों में से प्रत्येक में कितने उपस्तर निहित हैं?
स्तर एक के पास एक है सबलेवल - एक एस। स्तर 2 में 2. है उपस्तर - एस और पी। स्तर 3 में 3. है उपस्तर - एस, पी, और डी। स्तर 4 में 4 है उपस्तर - एस, पी, डी, और एफ।
कोई यह भी पूछ सकता है कि मुख्य ऊर्जा स्तर क्या है? रसायन शास्त्र में, मुख्य ऊर्जा स्तर एक इलेक्ट्रॉन के खोल या कक्षीय को संदर्भित करता है जिसमें इलेक्ट्रॉन परमाणु के नाभिक के सापेक्ष स्थित होता है। इस स्तर द्वारा दर्शाया गया है प्रधान क्वांटम संख्या n. आवर्त सारणी की अवधि में पहला तत्व एक नया परिचय देता है मुख्य ऊर्जा स्तर.
तो, पांचवें मुख्य ऊर्जा स्तर में कितने कक्षक हैं?
NS पांचवां ऊर्जा स्तर इसमें शामिल हैं: 5s (जिसमें 2 इलेक्ट्रॉन होते हैं), 5p (जिसमें 6 होते हैं), 5d (10 धारण करता है), और 5f (14 धारण करता है) कुल 32 इलेक्ट्रॉनों के लिए। उसके बाद, पांचवां , छठा, और सातवां उर्जा स्तर प्रत्येक के चार उपस्तर भी हैं।
निम्नलिखित ऊर्जा स्तरों में उपस्तर के प्रकार और कक्षकों की संख्या क्या है?
ऊर्जा स्तर आरेख भरने के लिए दिशात्मक पथ
| ऊर्जा स्तर n (शेल) | सबलेवल का प्रकार (सबशेल) | ऑर्बिटल्स की संख्या |
|---|---|---|
| 1 | एस | 1 |
| 2 | एस पी | 1 3 |
| 3 | एस पी डी | 1 3 5 |
| 4 | एस पी डी एफ | 1 3 5 7 |
सिफारिश की:
प्रथम ऊर्जा स्तर में कौन से उपस्तर होते हैं?

एस सबलेवल इसी तरह, यह पूछा जाता है कि ऊर्जा स्तरों के उपस्तर क्या हैं? s सबलेवल केवल एक कक्षीय है, इसलिए इसमें अधिकतम 2 इलेक्ट्रॉन हो सकते हैं। पी सबलेवल 3 ऑर्बिटल्स हैं, इसलिए अधिकतम 6 इलेक्ट्रॉन हो सकते हैं। द डू सबलेवल 5 ऑर्बिटल्स हैं, इसलिए अधिकतम 10 इलेक्ट्रॉन हो सकते हैं। और 4 सबलेवल 7 ऑर्बिटल्स हैं, इसलिए अधिकतम 14 इलेक्ट्रॉन हो सकते हैं। ऊपर के अलावा, एक परमाणु में ऊर्जा के कितने स्तर होते हैं?
पांचवें प्रमुख ऊर्जा स्तर में कितने कक्षक हैं?

प्रथम क्वांटम संख्या: कक्षीय और इलेक्ट्रॉन गणना प्रत्येक ऊर्जा स्तर के लिए n2 कक्षक होते हैं। n = 1 के लिए, 12 या एक कक्षक है। n = 2 के लिए, 22 या चार कक्षक हैं। n = 3 के लिए नौ कक्षक हैं, n = 4 के लिए 16 कक्षक हैं, n = 5 के लिए 52 = 25 कक्षक हैं, इत्यादि।
प्रत्येक उपस्तर में कितने इलेक्ट्रॉन होते हैं?

दो इलेक्ट्रॉन
ऊर्जा स्तरों में कितने इलेक्ट्रॉन होते हैं?

प्रत्येक शेल में केवल एक निश्चित संख्या में इलेक्ट्रॉन हो सकते हैं: पहला शेल दो इलेक्ट्रॉनों को धारण कर सकता है, दूसरा शेल आठ (2 + 6) इलेक्ट्रॉनों को धारण कर सकता है, तीसरा शेल 18 (2 + 6 + 10) तक हो सकता है। ) और इसी तरह। सामान्य सूत्र यह है कि nth शेल सिद्धांत रूप में 2(n2) इलेक्ट्रॉनों को धारण कर सकता है
निम्नलिखित में से कौन उन चीजों के उदाहरण दिखाता है जो विद्युत ऊर्जा को तापीय ऊर्जा में परिवर्तित करती हैं?

निम्नलिखित में से कौन उन चीजों के उदाहरण दिखाता है जो विद्युत ऊर्जा को तापीय ऊर्जा में परिवर्तित करती हैं? पंखा और पवन टरबाइन टोस्टर और रूम हीटर हवाई जहाज और मानव शरीर प्राकृतिक गैस स्टोव और ब्लेंडर
