
वीडियो: I3 का संकरण क्या है?
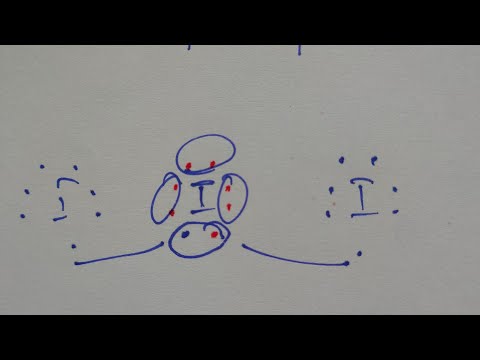
2024 लेखक: Miles Stephen | [email protected]. अंतिम बार संशोधित: 2023-12-15 23:36
मूल रूप से उत्तर दिया गया: i3. का संकरण क्या है? ? मैं3 ^- sp3d. है संकरण क्योंकि इसमें 3 लोनपेयर और 2 बॉन्ड पेयर हैं। चूंकि एकाकी जोड़े भूमध्यरेखीय स्थिति पर कब्जा कर लेते हैं और बंधन जोड़े अक्षीय स्थिति पर कब्जा कर लेते हैं, यह रैखिक आकार का होता है।
तदनुसार, आप i3 के संकरण की गणना कैसे करते हैं?
खोजने का एक और तरीका संकरण दिए गए अणु का एकाकी युग्म और संयोजी इलेक्ट्रॉनों की सहायता से होता है। इस अणु में एकाकी जोड़े की संख्या 3 है, और संयोजकता इलेक्ट्रॉनों को साझा करने वाले परमाणुओं की संख्या 2 है। इसलिए, 3+2=5 जो sp3d भी निर्धारित करता है संकरण . अणु का आकार मैं3 - रैखिक है।
इसी तरह, i3 माइनस की ज्यामिति क्या है? यह एक त्रिकोणीय द्विपिरामिड देता है आकार . इलेक्ट्रॉन जोड़े एक दूसरे को पीछे हटाते हैं, इसलिए वे एक दूसरे से अपनी दूरी को अधिकतम करना चाहते हैं, इसलिए वे एक दूसरे से 120 डिग्री भूमध्यरेखीय स्थिति लेते हैं, और दो अन्य आयोडीन एक दूसरे से 180 होते हैं। इस प्रकार कुल आकार रैखिक है।
तदनुसार, i3 ऋणात्मक का संकरण क्या है?
मैं3 - आण्विक ज्यामिति और बंधन कोण मैं3 - आणविक ज्यामिति रैखिक होती है। जबकि तीन आयोडीन परमाणु होते हैं, परमाणुओं में से एक में a. होता है नकारात्मक आवेश जो आगे 3 एकाकी इलेक्ट्रान और 2 बंध युग्म देता है। इसकी स्टेरिक संख्या 5 होगी। तीन एकाकी जोड़े एक दूसरे को प्रतिकर्षित करेंगे और विषुवतीय स्थिति ग्रहण करेंगे।
I3 में केंद्रीय आयोडीन परमाणु का संकरण क्या है -?
उत्तर है: केंद्रीय आयोडीन परमाणु त्रिआयोडाइड में sp3d संकरण . ट्रायोडाइड आयनों में केंद्रीय आयोडीन परमाणु इलेक्ट्रॉनों के तीन भूमध्यरेखीय एकाकी जोड़े होते हैं और टर्मिनल आयोडीन अक्षीय रूप से एक रैखिक आकार में बंधे होते हैं। sp3d में इलेक्ट्रॉन संकरण त्रिकोणाबिपिरामाइडल समरूपता में व्यवस्थित होते हैं।
सिफारिश की:
सिलिकॉन डाइऑक्साइड का संकरण क्या है?

सिलिका में सिलिकॉन 4 सिग्मा बांड बनाता है, इस प्रकार इसका संकरण होता है sp3
TeCl4 में केंद्रीय परमाणु का संकरण क्या है?

चूंकि TeCl4 में चार बंधन जोड़े और एक असीमित जोड़ी है, इसकी ज्यामिति त्रिकोणीय द्विपिरामिड संरचना पर आधारित है। लेकिन चूंकि केवल चार बंधन जोड़े हैं, अणु एक देखा-देखा आकार लेता है और असंबद्ध इलेक्ट्रॉन एक बंधुआ तत्व की जगह लेते हैं। त्रिकोणीय द्विपिरामिड संरचनाओं के लिए, संकरण sp3d . है
Sf6 में सल्फर का संकरण क्या है?

सल्फर हेक्साफ्लोराइड, SF6 में सल्फर परमाणु, sp3d2 संकरण प्रदर्शित करता है। सल्फर हेक्साफ्लोराइड के एक अणु में छह फ्लोरीन परमाणुओं को एक सल्फर परमाणु से जोड़ने वाले इलेक्ट्रॉनों के छह बंधन जोड़े होते हैं। केंद्रीय परमाणु पर इलेक्ट्रॉनों के एकाकी जोड़े नहीं होते हैं
संकरण के फायदे और नुकसान क्या हैं?

ज्यादातर मामलों में संकरण से बाँझपन हो सकता है। संकरण के लाभों में अनुकूल लक्षणों के साथ गुजरना और खतरे में पड़ी या लुप्तप्राय प्रजातियों के अस्तित्व को लम्बा खींचना शामिल है, लेकिन एक नुकसान यह है कि संकर जानवरों को साथी खोजने और सफलतापूर्वक प्रजनन करने में अधिक कठिनाई होती है।
पौधों में संकरण के क्या लाभ हैं?

संकरण के लाभ हैं: 1) वे उपज बढ़ा सकते हैं। 1) दो जातियाँ मिलकर सर्वोत्तम जीव का निर्माण करती हैं जिससे दोनों मूल प्रजातियों के अवांछित गुणों का नाश होता है। 2) वे जीवों के निर्माण में परिणत होते हैं जिनमें रोग प्रतिरोध, तनाव प्रतिरोध आदि जैसे विभिन्न गुण होते हैं
