
वीडियो: आयनिक यौगिक का गलनांक और क्वथनांक उच्च क्यों होता है?
2024 लेखक: Miles Stephen | [email protected]. अंतिम बार संशोधित: 2023-12-15 23:36
आयनिक यौगिकों में उच्च गलनांक और क्वथनांक होते हैं क्योंकि वहाँ एक है विपरीत आवेशित के बीच प्रबल इलेक्ट्रोस्टैटिक आकर्षण बल आयनों और इसलिए के बीच मजबूत बंधन बल को तोड़ने के लिए बड़ी मात्रा में ऊर्जा की आवश्यकता होती है आयनों.
लोग यह भी पूछते हैं कि आयनों का गलनांक और क्वथनांक उच्च क्यों होता है?
में ईओण का यौगिकों में विपरीत आवेशित के बीच एक प्रबल आकर्षण बल होता है आयनों , इसलिए के बीच मजबूत बंधन बल को तोड़ने के लिए बड़ी मात्रा में ऊर्जा की आवश्यकता होती है आयनों . इसीलिए ईओण का यौगिकों उच्च गलनांक और क्वथनांक है.
दूसरे, किस आयनिक यौगिक का गलनांक अधिक होता है? सामान्य तौर पर, जितना अधिक चार्ज, उतना ही अधिक इलेक्ट्रोस्टैटिक आकर्षण, आयनिक बंधन जितना मजबूत होता है, पिघलने बिंदु उतना ही अधिक होता है। नीचे दी गई तालिका दो आयनिक यौगिकों, सोडियम क्लोराइड के गलनांक और आयन आवेशों की तुलना करती है ( सोडियम क्लोराइड ) और मैग्नीशियम ऑक्साइड (MgO)।
इसके अतिरिक्त, क्या आयनिक यौगिकों में उच्च क्वथनांक होते हैं?
आयनिक यौगिकों का क्वथनांक अधिक होता है . के बीच आकर्षक बल आयनों सहसंयोजक अणुओं के बीच की तुलना में बहुत मजबूत हैं। को अलग करने में लगभग 1000 से 17,000 kJ/mol का समय लगता है आयनों में आयनिक यौगिक.
क्या सहसंयोजक यौगिकों में उच्च क्वथनांक होते हैं?
सहसंयोजक बांड परमाणुओं के बीच हैं काफी मजबूत, लेकिन अणुओं के बीच आकर्षण/ यौगिकों , या अंतर-आणविक बल, कर सकते हैं अपेक्षाकृत कमजोर हो। सहसंयोजक यौगिक आम तौर पर पास होना कम उबलना तथा गलनांक , तथा हैं कमरे में तीनों भौतिक अवस्थाओं में पाया जाता है तापमान.
सिफारिश की:
क्या नैनोट्यूब में उच्च गलनांक होता है?

सेटअप ने अलग-अलग नैनोकणों में हेरफेर करने और व्यक्तिगत सीएनटी को वर्तमान में लागू करके उन्हें गर्म करने की अनुमति दी। सीएनटी 60-एनएम-व्यास वाले डब्ल्यू कणों (~ 3400 के) के पिघलने बिंदु तक उच्च तापमान का सामना करने के लिए पाए गए थे।
किस अधातु का गलनांक और क्वथनांक उच्च होता है?

हीरा कार्बन का एक अपररूप/रूप है। तो, कार्बन (हीरे के रूप में) एकमात्र अधातु है जिसका गलनांक बहुत अधिक होता है
पानी का गलनांक उच्च क्यों होता है?
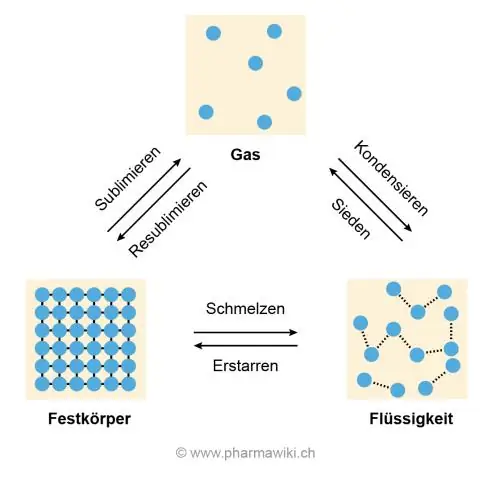
उच्च पिघलने और उबलते तापमान का कारण पानी के अणुओं के बीच हाइड्रोजन बंधन है जो उन्हें एक साथ चिपकने और अलग होने का विरोध करने का कारण बनता है जो तब होता है जब बर्फ पिघलती है और पानी गैस बनने के लिए उबलता है
सोडियम का गलनांक उच्च क्यों होता है?

सोडियम क्लोराइड का एक उच्च गलनांक होता है क्योंकि इसके सकारात्मक और नकारात्मक आयनों के बीच मजबूत इलेक्ट्रोस्टैटिक आकर्षण होता है; इसे दूर करने के लिए अधिक ऊष्मा ऊर्जा की आवश्यकता होती है। इसमें एक विशाल जालीदार संरचना भी है, जिसका अर्थ है कि इसमें लाखों मजबूत आयनिक बंधन होते हैं
पानी का क्वथनांक और गलनांक उच्च क्यों होता है?

उच्च पिघलने और उबलते तापमान का कारण पानी के अणुओं के बीच हाइड्रोजन बंधन है जो उन्हें एक साथ चिपकने और अलग होने का विरोध करने का कारण बनता है जो तब होता है जब बर्फ पिघलती है और पानी गैस बनने के लिए उबलता है
