विषयसूची:

वीडियो: घरेलू अम्ल और क्षार के कुछ उदाहरण क्या हैं?
2024 लेखक: Miles Stephen | [email protected]. अंतिम बार संशोधित: 2024-01-18 08:15
घरेलू क्षारों और अम्लों की सूची
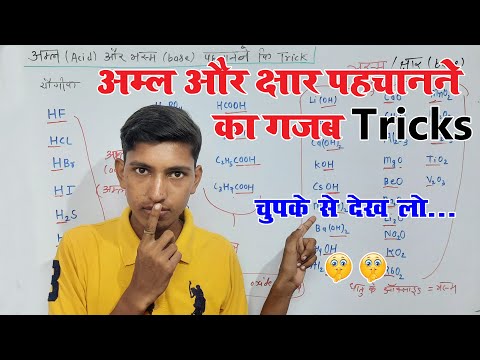
- पाक सोडा . बेकिंग सोडा सोडियम बाइकार्बोनेट का सामान्य नाम है, जिसे रासायनिक रूप से NaHCO3 के रूप में जाना जाता है।
- पतला साबुन।
- घरेलू अमोनिया।
- घरेलू सिरका।
- साइट्रिक एसिड।
इसी तरह, घरेलू आधार के कुछ उदाहरण क्या हैं?
आम घरेलू रासायनिक आधारों में अमोनिया, बेकिंग सोडा और लाइ शामिल हैं।
- पाक सोडा। बेकिंग सोडा, या सोडियम बाइकार्बोनेट (NaHCO3) का पीएच 8.3 है, जो आसुत जल के पीएच 7.0 से अधिक है।
- बोरेक्स: सफाई और कीट नियंत्रण।
- मिल्क ऑफ मैग्नेशिया (मैग्नीशियम हाइड्रॉक्साइड)
- अमोनिया, गंदगी का दुश्मन।
- लाइ: क्लॉग बस्टर।
इसके अतिरिक्त, 10 सामान्य घरेलू अम्ल क्या हैं?
- कार्बोनिक एसिड (शीतल पेय)
- सिरका (एसिटिक एसिड)
- बैटरी एसिड (सल्फ्यूरिक एसिड)
- साइट्रिक एसिड (नींबू)
- टार्टरिक एसिड (इमली: खाना पकाने के लिए)
- लैक्टिक एसिड (खट्टा दूध, दही)
- हाइड्रोक्लोरिक एसिड (टिन सोल्डरिंग फ्लक्स के रूप में प्रयुक्त)
- शैम्पू (सैलिसिलिक एसिड) आदि।
इसे ध्यान में रखते हुए, सामान्य घरेलू अम्ल और क्षार क्या हैं?
घरेलू आधार कुछ घरेलू सामान जिनमें एसिड होता है उनमें शामिल हैं: दही, सिरका, नींबू का रस, साइट्रिक एसिड , सेब, जेली, अनानास, क्रैनबेरी सॉस, दूध और बैटरी।
आधार के 5 उदाहरण क्या हैं?
क्षार और क्षार के उदाहरण
- सोडियम हाइड्रॉक्साइड (NaOH) या कास्टिक सोडा।
- कैल्शियम हाइड्रॉक्साइड (Ca(OH)2) या चूना पानी।
- अमोनियम हाइड्रॉक्साइड (NH.)4OH) या अमोनिया पानी।
- मैग्नीशियम हाइड्रॉक्साइड (Mg(OH)2) या मैग्नीशिया का दूध।
- कई ब्लीच, साबुन, टूथपेस्ट और सफाई एजेंट।
सिफारिश की:
क्या आप अम्ल में क्षार या क्षार में अम्ल मिलाते हैं?

अम्ल मिलाने से विलयन में H3O+ आयनों की सांद्रता बढ़ जाती है। क्षार जोड़ने से विलयन में H3O+ आयनों की सांद्रता घट जाती है। अम्ल और क्षार रासायनिक विपरीत हैं। यदि किसी अम्लीय विलयन में क्षार मिला दिया जाए, तो विलयन कम अम्लीय हो जाता है और pH पैमाने के मध्य की ओर गति करता है
क्षार और अम्ल क्या हैं?

क्षार का pH 7 से अधिक होता है तटस्थ पदार्थों का pH 7 के बराबर होता है। अम्ल और क्षार दोनों में आयन होते हैं। एसिड में बहुत सारे हाइड्रोजन आयन होते हैं, जिनका प्रतीक H+ होता है। क्षार में बहुत सारे हाइड्रॉक्साइड आयन होते हैं, प्रतीक OH-। जल उदासीन है क्योंकि हाइड्रोजन आयनों की संख्या हाइड्रॉक्साइड आयनों की संख्या के बराबर होती है
क्या होता है जब आप प्रबल अम्ल को दुर्बल क्षार के साथ मिलाते हैं?

टाइप 2: जब एक मजबूत एसिड / बेस कमजोर बेस / एसिड के साथ प्रतिक्रिया करता है यदि हाइड्रोनियम और हाइड्रॉक्सिल आयन बराबर एएमटी में मौजूद होते हैं तो नमक और पानी बनता है और ऊर्जा निकलती है जो कि के पृथक्करण के कारण 57 kj / मोल से बहुत कम है। कमजोर अम्ल/क्षार जो सामान्यत: ऊष्माशोषी होता है
कुछ सामान्य घरेलू अम्ल और क्षार क्या हैं?

घरेलू क्षार और अम्ल बेकिंग सोडा की सूची। बेकिंग सोडा सोडियम बाइकार्बोनेट का सामान्य नाम है, जिसे रासायनिक रूप से NaHCO3 के रूप में जाना जाता है। पतला साबुन। घरेलू अमोनिया। घरेलू सिरका। साइट्रिक एसिड
अम्ल को अम्ल और क्षार को क्षार क्या बनाता है?

अम्ल एक ऐसा पदार्थ है जो हाइड्रोजन आयन देता है। इस वजह से, जब एक एसिड पानी में घुल जाता है, तो हाइड्रोजन आयनों और हाइड्रॉक्साइड आयनों के बीच संतुलन बदल जाता है। इस प्रकार का विलयन अम्लीय होता है। क्षार वह पदार्थ है जो हाइड्रोजन आयन स्वीकार करता है
