
वीडियो: कौन सा तत्व इलेक्ट्रॉन प्राप्त करता है या खो देता है?
2024 लेखक: Miles Stephen | [email protected]. अंतिम बार संशोधित: 2023-12-15 23:36
तत्वों जो धातुएं होती हैं इलेक्ट्रॉन खोना और धनायन कहलाने वाले धनावेशित आयन बन जाते हैं। तत्वों जो अधातुएं होती हैं इलेक्ट्रॉन प्राप्त करें और ऋणावेशित आयन बन जाते हैं जिन्हें ऋणायन कहते हैं। आवर्त सारणी के कॉलम 1A में स्थित धातुएँ किसके द्वारा आयन बनाती हैं? हारी एक इलेक्ट्रॉन.
इसी तरह, कौन से तत्व इलेक्ट्रॉन प्राप्त करने की अपेक्षा करेंगे?
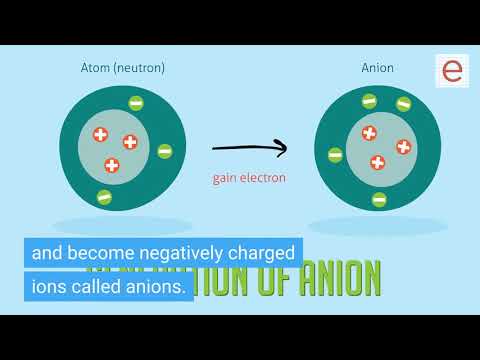
nonmetals (चार्ट का दाहिना 1/3) जब वे आयनिक यौगिक बनाते हैं तो इलेक्ट्रॉनों को प्राप्त करके ऐसा करते हैं। यह इस तथ्य के कारण है कि उनके पास उच्च आयनीकरण ऊर्जा और उच्च इलेक्ट्रॉन समानताएं हैं (इलेक्ट्रॉनों को इकट्ठा करने की उनकी क्षमता का उल्लेख करते हुए)। जब वे आयन बनाते हैं, तो वे ऋणात्मक आवेश के होते हैं और ऋणायन कहलाते हैं।
इसके अतिरिक्त, प्रत्येक तत्व कितने इलेक्ट्रॉन प्राप्त करेगा या खोएगा? सभी समूह 1 परमाणु हार सकते हैं एक इलेक्ट्रॉन सकारात्मक रूप से आवेशित आयन बनाने के लिए। उदाहरण के लिए, पोटेशियम परमाणु ऐसा ही आयन बनाने के लिए करते हैं इलेक्ट्रॉन नोबल गैस आर्गन के रूप में विन्यास। समूह 2 परमाणु खोना दो इलेक्ट्रॉनों सकारात्मक रूप से आवेशित आयन बनाने के लिए।
नतीजतन, कौन से तत्व सबसे आसानी से इलेक्ट्रॉनों को खो देते हैं?
विशेष रूप से, सीज़ियम (Cs) अपनी संयोजकता छोड़ सकता है इलेक्ट्रॉन अधिक सरलता लिथियम (ली) की तुलना में। वास्तव में, क्षार धातुओं के लिए (.) तत्वों समूह 1 में), छोड़ने में आसानी a इलेक्ट्रॉन निम्नानुसार भिन्न होता है: सीएस> आरबी> के> ना> ली के साथ सीएस the अधिकांश संभावना है, और ली कम से कम संभावना है, तो खोना एक इलेक्ट्रॉन.
तत्व इलेक्ट्रॉन क्यों प्राप्त करना चाहते हैं?
परमाणुओं बढ़त /खोना इलेक्ट्रॉनों स्थिर होने के लिए अपने अष्टक या द्वैत को पूरा करने के लिए। चूँकि उत्कृष्ट गैसों ने पहले ही अधिकतम स्थिरता प्राप्त कर ली है क्योंकि उनके सबसे बाहरी कोश पूरे हो चुके हैं, हम कह सकते हैं कि परमाणु चाहता हे स्थिर होने के लिए उत्कृष्ट गैसों के सदृश होना।
सिफारिश की:
परमाणु इलेक्ट्रॉन कैसे प्राप्त करते हैं और कैसे खोते हैं?

आयनिक बंध। हमारी क्रूड, वैचारिक परिभाषा के अनुसार, रासायनिक बंधन या तो परमाणुओं के बीच इलेक्ट्रॉन हस्तांतरण या इलेक्ट्रॉनों के बंटवारे से बन सकते हैं। जब परमाणु इलेक्ट्रॉन खो देते हैं या प्राप्त कर लेते हैं, तो वे आयन कहलाते हैं। इलेक्ट्रॉनों की हानि एक परमाणु को शुद्ध धनात्मक आवेश के साथ छोड़ देती है, और परमाणु को धनायन कहा जाता है
किसी तत्व का सबसे छोटा कण कौन सा है जो तत्व के गुणों को बरकरार रखता है?

परमाणु किसी भी तत्व का सबसे छोटा कण होता है जो उस तत्व की विशेषताओं को बरकरार रखता है। एक तत्व का एक टुकड़ा जिसे हम देख सकते हैं या संभाल सकते हैं, कई परमाणुओं से बना होता है और सभी परमाणु समान होते हैं, सभी में समान संख्या में प्रोटॉन होते हैं
रासायनिक बंधन में कौन से तत्व सबसे अधिक इलेक्ट्रॉन प्राप्त करने की संभावना रखते हैं?

नोबल गैस विन्यास प्राप्त करने के लिए अधातुओं में इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति होती है। अपेक्षाकृत उच्च इलेक्ट्रॉन समानताएं और उच्च आयनीकरण ऊर्जाएं होती हैं। धातुएं इलेक्ट्रॉनों को खो देती हैं और गैर-धातुएं इलेक्ट्रॉनों को प्राप्त करती हैं, इसलिए इन दो समूहों की प्रतिक्रियाओं में धातु से अधातु में इलेक्ट्रॉन स्थानांतरण होता है।
कौन सा तत्व किसी तत्व को उपधातु बनाता है?

मेटलॉइड एक ऐसा तत्व है जिसमें धातु और अधातु दोनों के गुण होते हैं, और इसलिए इसे धातु या अधातु के रूप में वर्गीकृत करना कठिन होता है। बोरॉन, सिलिकॉन, जर्मेनियम, आर्सेनिक, सुरमा और टेल्यूरियम को आमतौर पर मेटलॉइड के रूप में पहचाना जाता है
बीजाणु हरा क्यों दिखाई देता है जबकि कोशिका शरीर गुलाबी दिखाई देता है?

समाप्त एंडोस्पोर दाग में कोशिका शरीर गुलाबी दिखाई देने पर बीजाणु हरा क्यों दिखाई देता है? बीजाणु हरा दिखाई देता है क्योंकि गर्मी ने बीजाणु को रंगीन डाई में लेने के लिए मजबूर कर दिया, जो आसानी से बाहर निकल जाता है यदि कोशिका शरीर
