विषयसूची:

वीडियो: आप अम्ल क्षारक अनुमापन कैसे करते हैं?
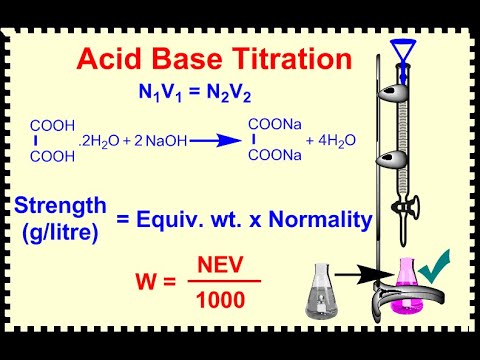
2024 लेखक: Miles Stephen | [email protected]. अंतिम बार संशोधित: 2023-12-15 23:36
अनुमापन प्रक्रिया
- ब्यूरेट को मानक विलयन से, पिपेट को अज्ञात विलयन से और शंक्वाकार फ्लास्क को आसुत जल से धो लें।
- संकेतक की कुछ बूंदों के साथ, पिपेट का उपयोग करके एर्लेनमेयर फ्लास्क में विश्लेषण की एक सटीक मापी गई मात्रा रखें।
यहाँ, उदाहरण के साथ अम्ल क्षार अनुमापन क्या है?
के लिये उदाहरण , हाइड्रोक्लोरिक अम्ल और सोडियम हाइड्रॉक्साइड सोडियम क्लोराइड और पानी बनाते हैं: HCl(aq)+NaOH(aq)→H2O(l)+NaCl(aq) उदासीनीकरण का आधार है टाइट्रेट करना . एक पीएच संकेतक तुल्यता बिंदु को दर्शाता है - वह बिंदु जिस पर a. के मोल की बराबर संख्या होती है आधार को जोड़ा गया है अम्ल.
इसी प्रकार अम्ल क्षार अनुमापन का क्या अर्थ है? एक अम्ल – आधार अनुमापन किसी की सांद्रता का निर्धारण करने के लिए मात्रात्मक विश्लेषण की एक विधि है अम्ल या आधार के एक मानक समाधान के साथ इसे बिल्कुल बेअसर करके आधार या अम्ल ज्ञात एकाग्रता होना।
इसके अलावा, अम्ल क्षार अनुमापन का उद्देश्य क्या है?
परिचय। NS प्रयोजन एक मजबूत का अम्ल -मजबूत आधार अनुमापन अम्लीय घोल की सांद्रता को किसके द्वारा निर्धारित करना है अनुमापन यह ज्ञात एकाग्रता के मूल समाधान के साथ, या इसके विपरीत, जब तक कि तटस्थता न हो।
अनुमापन में अंतिम बिंदु क्या है?
अंत बिंदु . अंतिम बिंदु : NS बिंदु एक के दौरान टाइट्रेट करना जब एक संकेतक दिखाता है कि एक पूर्ण प्रतिक्रिया के लिए आवश्यक अभिकारक की मात्रा एक समाधान में जोड़ दी गई है।
सिफारिश की:
अनुमापन क्या है और अनुमापन के प्रकार

अनुमापन के प्रकार • अम्ल-क्षार अनुमापन, जिसमें एक अम्लीय या क्षारकीय अनुमापांक एक ऐसे विश्लेषण के साथ प्रतिक्रिया करता है जो एक क्षार या अम्ल है। वर्षा अनुमापन, जिसमें विश्लेषक और अनुमापांक अभिक्रिया करके अवक्षेप बनाते हैं। • रेडॉक्स अनुमापन, जहां टाइट्रेंट एक ऑक्सीकरण या कम करने वाला एजेंट है
किसी क्षारक को उदासीन करने के लिए आवश्यक अम्ल की मात्रा का निर्धारण आप किस प्रकार करते हैं?

एसिड-बेस न्यूट्रलाइजेशन समस्या को हल करना चरण 1: OH- के मोल की संख्या की गणना करें। मोलरिटी = मोल/वॉल्यूम। मोल = मोलरिटी x आयतन। मोल ओएच- = 0.02 एम/100 मिलीलीटर। चरण 2: आवश्यक एचसीएल की मात्रा की गणना करें। मोलरिटी = मोल/वॉल्यूम। आयतन = मोल/मोलरिटी। आयतन = मोल एच+/0.075 मोलरिटी
क्या प्रबल अम्ल और दुर्बल क्षारक बफर बना सकते हैं?

जैसा कि आपने विलयनों के पीएच की गणना में देखा है, पीएच में भारी बदलाव के लिए केवल एक मजबूत एसिड की थोड़ी मात्रा आवश्यक है। एक बफर केवल एक कमजोर एसिड और उसके संयुग्म आधार या कमजोर आधार और उसके संयुग्मित एसिड का मिश्रण होता है। पीएच को नियंत्रित करने के लिए किसी भी अतिरिक्त एसिड या बेस के साथ प्रतिक्रिया करके बफर काम करते हैं
आप अनुमापन समस्याओं की गणना कैसे करते हैं?

अनुमापन समस्या चरण-दर-चरण समाधान चरण 1: निर्धारित करें [OH-] NaOH के प्रत्येक मोल में OH- का एक मोल होगा। चरण 2: OH के मोलों की संख्या ज्ञात कीजिए- मोलरता = मोलों की संख्या/आयतन। चरण 3: H+ के मोलों की संख्या ज्ञात कीजिए चरण 4: HCl . की सांद्रता ज्ञात कीजिए
जब अम्ल, क्षारक से अभिक्रिया करता है तो अभिक्रिया क्या कहलाती है?

अम्ल और क्षार की अभिक्रिया उदासीनीकरण अभिक्रिया कहलाती है। इस प्रतिक्रिया के उत्पाद नमक और पानी हैं। उदाहरण के लिए, सोडियम हाइड्रोक्साइड, NaOH, के साथ हाइड्रोक्लोरिक एसिड, HCl की प्रतिक्रिया से सोडियम क्लोराइड, NaCl और कुछ अतिरिक्त पानी के अणुओं का घोल बनता है।
