विषयसूची:

वीडियो: आप अवोगाद्रो के नियम को कैसे हल करते हैं?
2024 लेखक: Miles Stephen | [email protected]. अंतिम बार संशोधित: 2023-12-15 23:36
निरंतर दबाव और तापमान पर, अवोगाद्रो के नियम को निम्न सूत्र द्वारा व्यक्त किया जा सकता है:
- वी एन.
- वी / एन = के।
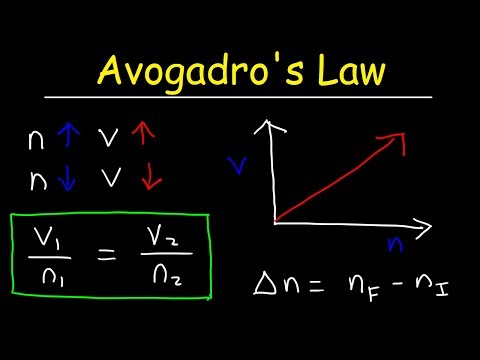
- वी1/एन1 = वी2/एन2 (= कश्मीर, अनुसार अवोगाद्रो का नियम ).
- पीवी = एनआरटी।
- वी/एन = (आरटी)/पी।
- वी / एन = के।
- के = (आरटी) / पी।
- हीलियम गैस का एक मोल एक खाली गुब्बारे में 1.5 लीटर का आयतन भरता है।
इसके संबंध में अवोगाद्रो के नियम का सूत्र क्या है?
अवोगाद्रो का नियम सूत्र जहाँ "V" गैस का आयतन है, "n" गैस की मात्रा है (गैस के मोलों की संख्या) और "k" किसी दिए गए दबाव और तापमान के लिए एक स्थिरांक है। असल में, अवोगाद्रो का नियम , उनके द्वारा निर्धारित परिकल्पना, उनमें से थी कानून जिस पर आदर्श गैस कानून आधारित है।
यह भी जानिए, क्या है बॉयल का सूत्र? भौतिक विज्ञानी रॉबर्ट द्वारा तैयार किया गया यह अनुभवजन्य संबंध बॉयल 1662 में, बताता है कि गैस की एक निश्चित मात्रा का दबाव (पी) स्थिर तापमान पर इसके आयतन (v) के साथ व्युत्क्रमानुपाती होता है; यानी, में समीकरण रूप, पीवी = के, एक स्थिरांक।
इसके अलावा, अवोगाद्रो के नियम का एक उदाहरण क्या है?
अवोगाद्रो का नियम बताता है कि गैस का आयतन गैस के मोलों की संख्या के सीधे आनुपातिक होता है। यहाँ कुछ हैं उदाहरण . जैसे ही आप बास्केटबॉल को उड़ाते हैं, आप उसमें अधिक गैस अणुओं को मजबूर कर रहे हैं। जितने अधिक अणु, उतने अधिक आयतन। दोनों गुब्बारों में समान संख्या में अणु होते हैं।
अवोगाद्रो का नियम क्या बताता है?
अवोगाद्रो का नियम (कभी-कभी के रूप में संदर्भित अवोगाद्रो का परिकल्पना या अवोगाद्रो का सिद्धांत) है एक प्रायोगिक गैस कानून गैस के आयतन से संबंधित गैस के पदार्थ की मात्रा से संबंधित। अवोगाद्रो का नियम कहता है कि "सभी गैसों के समान आयतन, समान तापमान और दबाव पर, अणुओं की संख्या समान होती है।"
सिफारिश की:
आप भागफल नियम को उत्पाद नियम में कैसे बदलते हैं?

भागफल नियम को उत्पाद और श्रृंखला नियमों के अनुप्रयोग के रूप में देखा जा सकता है। यदि Q(x) = f(x)/g(x), तो Q(x) = f(x) * 1/(g(x))। आप Q(x) में अंतर करने के लिए उत्पाद नियम का उपयोग कर सकते हैं, और 1/(g(x)) को u = g(x), और 1/(g(x)) = 1/u के साथ श्रृंखला नियम का उपयोग करके विभेदित किया जा सकता है
अवोगाद्रो के नियम का क्या महत्व है?

अवोगाद्रो का नियम गैस की मात्रा (n) और आयतन (v) के बीच संबंध की जाँच करता है। यह एक सीधा संबंध है, जिसका अर्थ है कि गैस का आयतन गैस के नमूने में मौजूद मोल्स की संख्या के सीधे आनुपातिक है
आप अवोगाद्रो के नियम को कैसे प्रदर्शित करते हैं?

जब भी आप कोई गुब्बारा उड़ाते हैं तो अवोगाद्रो का नियम प्रमाण में होता है। जैसे ही आप गुब्बारे को फूंक मारकर उसमें मोल गैस डालते हैं, गुब्बारे का आयतन बढ़ जाता है। यदि गैस रखने वाला कंटेनर लचीला होने के बजाय कठोर है, तो अवोगाद्रो के नियम में आयतन के लिए दबाव को प्रतिस्थापित किया जा सकता है
अवोगाद्रो के नियम का उपयोग करके आप आयतन कैसे ज्ञात करते हैं?

अवोगाद्रो का नियम बताता है कि गैस के मोलों की संख्या और उसके आयतन के बीच सीधा संबंध होता है। इसे समीकरण का उपयोग करके भी दिखाया जा सकता है: V1/n1 = V2/n2। यदि मोलों की संख्या दोगुनी कर दी जाए, तो आयतन दोगुना हो जाएगा
अवोगाद्रो के नियम का प्रयोग किस प्रकार किया जाता है ?

अवोगाद्रो का नियम कहता है कि गैस का आयतन गैस के मोलों की संख्या के समानुपाती होता है। जैसे ही आप बास्केटबॉल को उड़ाते हैं, आप उसमें अधिक गैस अणुओं को मजबूर कर रहे हैं। जितने अधिक अणु, उतने अधिक आयतन। बास्केटबॉल फुलाता है
