
वीडियो: अवोगाद्रो के नियम का उपयोग करके आप आयतन कैसे ज्ञात करते हैं?
2024 लेखक: Miles Stephen | [email protected]. अंतिम बार संशोधित: 2023-12-15 23:36
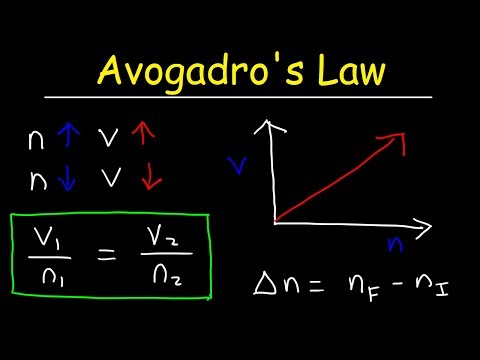
अवोगाद्रो का नियम दर्शाता है कि गैस के मोलों की संख्या और उसके के बीच सीधा संबंध है आयतन . यह भी दिखाया जा सकता है का उपयोग करते हुए समीकरण: V1/n1 = V2/n2। यदि मोलों की संख्या दोगुनी कर दी जाए, तो आयतन दोगुना हो जाएगा।
इस प्रकार अवोगाद्रो के नियम का सूत्र क्या है?
अवोगाद्रो का नियम सूत्र जहाँ "V" गैस का आयतन है, "n" गैस की मात्रा है (गैस के मोलों की संख्या) और "k" किसी दिए गए दबाव और तापमान के लिए एक स्थिरांक है। असल में, अवोगाद्रो का नियम , उनके द्वारा निर्धारित परिकल्पना, उनमें से थी कानून जिस पर आदर्श गैस कानून आधारित है।
इसके अतिरिक्त, अवोगाद्रो के नियम का एक उदाहरण क्या है? अवोगाद्रो का नियम बताता है कि गैस का आयतन गैस के मोलों की संख्या के सीधे आनुपातिक होता है। यहाँ कुछ हैं उदाहरण . जैसे ही आप बास्केटबॉल को उड़ाते हैं, आप उसमें अधिक गैस अणुओं को मजबूर कर रहे हैं। जितने अधिक अणु, उतने अधिक आयतन। दोनों गुब्बारों में समान संख्या में अणु होते हैं।
इसके अलावा, अवोगाद्रो का कानून क्या बताता है कि यह प्रयोगशाला कानून को साबित करती है आप कैसे जानते हैं?
एक आधुनिक कथन है : अवोगाद्रो का नियम कहता है कि "सभी गैसों के समान आयतन, समान तापमान और दबाव पर, अणुओं की संख्या समान होती है।" an. के दिए गए द्रव्यमान के लिए आदर्श गैस , गैस का आयतन और मात्रा (मोल) हैं सीधे आनुपातिक अगर तापमान और दबाव हैं लगातार।
अवोगाद्रो की परिकल्पना द्वारा मात्राओं के संयोजन के नियम की व्याख्या कैसे की गई है?
(ए) मात्राओं के संयोजन का नियम द्वारा अवोगाद्रो की परिकल्पना : सभी गैसें जिनमें बराबर होती हैं संस्करणों तापमान और दबाव की समान बाहरी स्थितियों में अणुओं की संख्या समान होगी। गैस के ये अणु छोटी पूर्ण संख्याओं के अनुपात में प्रतिक्रिया करते हैं, इसलिए उनकी (गैस) संस्करणों छोटी पूर्ण संख्याओं के अनुपात में भी होगा।
सिफारिश की:
आप अशक्त कारक नियम का उपयोग करके द्विघात समीकरण को कैसे हल करते हैं?

इससे हम यह निष्कर्ष निकाल सकते हैं कि: यदि किन्हीं दो संख्याओं का गुणनफल शून्य है, तो एक या दोनों संख्याएँ शून्य हैं। अर्थात्, यदि ab = 0, तो a = 0 या b = 0 (जिसमें संभावना है कि a = b = 0) शामिल है। इसे नल कारक नियम कहा जाता है; और हम इसका उपयोग अक्सर द्विघात समीकरणों को हल करने के लिए करते हैं
डेसकार्टेस के संकेतों के नियम का उपयोग करके आप काल्पनिक मूल कैसे प्राप्त करते हैं?

डेसकार्टेस के संकेतों का नियम कहता है कि सकारात्मक जड़ों की संख्या f (x) के संकेत में परिवर्तन के बराबर है, या एक सम संख्या से कम है (इसलिए आप 2 को तब तक घटाते रहते हैं जब तक कि आपको 1 या 0 प्राप्त न हो जाए)। इसलिए, पिछले f(x) के 2 या 0 धनात्मक मूल हो सकते हैं। नकारात्मक वास्तविक जड़ें
अनुभवजन्य नियम का उपयोग करके आप अनुमानित प्रतिशत कैसे ज्ञात करते हैं?

वक्र के नीचे का क्षेत्रफल x = 9 से x = 13 तक ज्ञात करना। अनुभवजन्य नियम या 68-95-99.7% नियम डेटा का अनुमानित प्रतिशत देता है जो एक मानक विचलन (68%), दो मानक विचलन (95%) के अंतर्गत आता है। , और माध्य के तीन मानक विचलन (99.7%)
पाई का उपयोग करके आप किसी वृत्त की त्रिज्या कैसे ज्ञात करते हैं?
परिधि का उपयोग करके एक वृत्त की त्रिज्या की गणना करने के लिए, वृत्त की परिधि लें और इसे 2 गुना π से विभाजित करें। 15 की परिधि वाले एक वृत्त के लिए, आप 15 को 2 गुणा 3.14 से विभाजित करेंगे और दशमलव बिंदु को लगभग 2.39 के अपने उत्तर में गोल करेंगे।
आप एक जाल का उपयोग करके पिरामिड का पृष्ठीय क्षेत्रफल कैसे ज्ञात करते हैं?

वीडियो इसके संबंध में पिरामिड का कुल पृष्ठीय क्षेत्रफल कितना है? NS पिरामिड का पृष्ठीय क्षेत्रफल जब सभी पार्श्व फलक समान हों: [आधार क्षेत्र ] + 1 / 2 × परिधि × [तिरछी लंबाई] कोई यह भी पूछ सकता है कि आप किसी गोले का पृष्ठीय क्षेत्रफल कैसे ज्ञात करते हैं?
